Há mais de 2.000 anos, o filósofo grego Demócrito disse que se um objeto fosse dividido em partes cada vez menores, o resultado seria pedaços tão pequenos que não seria possível dividí-los. E chamou esses pequenos pedaços de átomos- palavra grega que significa inseparáveis.

terça-feira, 31 de maio de 2011
domingo, 29 de maio de 2011
O Átomo Legendado
Video interessante. A contribuição de Albert Einstein nos átomos.
Tem mais capítulos no you tube. é bem interessante.
Postado por Isadora
quarta-feira, 25 de maio de 2011
Falando de Átomos!: Átomos em quadrinhos (Capitão Átomo)
Falando de Átomos!: Átomos em quadrinhos (Capitão Átomo): "Este é um personagem ficcional !!!!! O nome deste capitão moderno foi estabelecido como Nathaniel Christopher Adam, um oficial da Força Aére..."
Átomo Molecular a sua microextrutura
Micro-biotech, átomo, molecular, estrutura, micro, methotrexate
Fonte:http://www.fotosearch.com.br/
Postado por: Rosimaira
Fonte:http://www.fotosearch.com.br/
Postado por: Rosimaira
Conceitos Fundamentais - Características dos átomos
A ? Número Atômico (Z): é o número de prótons do núcleo de um átomo.
B ? Número de Massa (A): é a soma do número de prótons com o número de nêutrons (N) do núcleo de um átomo.
A = Z + N
C ? Elemento Químico: é o conjunto de átomos que apresentam o mesmo número atômico.
número atômico: 6
número de massa: 12
número de nêutrons: 6 (A ? Z)
D ? Isóbaros: são elementos químicos diferentes que apresentam mesmo número de massa.
E ? Isótonos: são elementos químicos diferentes que apresentam mesmo número de nêutrons.
F ? Isótopos: são átomos de um mesmo elemento químico que apresentamdiferentes números de nêutrons e, conseqüentemente, diferentes números de massa.
Exemplo:
6 C 14 e 7 N 14 são isóbaros
17 Cl 37 e 20 Ca 40 são isótonos
17 Cl 35 e 17 Cl 37 são isótopos
Fonte:http://www.sofi.com.br/node
Postado:Rosimaira
B ? Número de Massa (A): é a soma do número de prótons com o número de nêutrons (N) do núcleo de um átomo.
A = Z + N
C ? Elemento Químico: é o conjunto de átomos que apresentam o mesmo número atômico.
Exemplo:
6 C 12 - o elemento carbono apresenta:
número atômico: 6
número de massa: 12
número de nêutrons: 6 (A ? Z)
D ? Isóbaros: são elementos químicos diferentes que apresentam mesmo número de massa.
E ? Isótonos: são elementos químicos diferentes que apresentam mesmo número de nêutrons.
F ? Isótopos: são átomos de um mesmo elemento químico que apresentamdiferentes números de nêutrons e, conseqüentemente, diferentes números de massa.
Exemplo:
6 C 14 e 7 N 14 são isóbaros
17 Cl 37 e 20 Ca 40 são isótonos
17 Cl 35 e 17 Cl 37 são isótopos
Fonte:http://www.sofi.com.br/node
Postado:Rosimaira
Átomos em quadrinhos (Capitão Átomo)
Este é um personagem ficcional !!!!!
O nome deste capitão moderno foi estabelecido como Nathaniel Christopher Adam, um oficial da Força Aérea dos Estados Unidos da época da Guerra do Vietnam. Adam tinha sido culpado por um crime que ele não cometeu e condenado à morte sob os olhos do Coronel Wade Eiling em 1968. Como uma alternativa à execução, ele foi convidado para participar em um experimento militar com pouca possibilidade da sobrevivência, em troca de um perdão presidencial. O experimento implicou provar a durabilidade da couraça duma nave alienígena que havia caído na Terra, por explodir uma bomba nuclear embaixo dela, com Adam dentro da couraça. Adam sobreviveu como o metal derreteu no seu corpo e a energia excessiva.
Fonte: http:// Wikipéia .org.com
Postado por:Rosimaira
Meio Ambiente Átomo
É sabido que o átomo isoladamente não tem:
Ponto de fusão.
Ponto de ebulição.
Volume molar.
Densidade.
Também é sabido que o átomo tem:
Raio atômico.
Raio iônico.
Energia de ionização.
Portanto, átomos são os componentes básicos das moléculas e da matéria comum.
Fonte: http://www.achetudoeregiao.com.br/animais/atomo.htm
Postado por: Rosimaira
Ponto de fusão.
Ponto de ebulição.
Volume molar.
Densidade.
Também é sabido que o átomo tem:
Raio atômico.
Raio iônico.
Energia de ionização.
Portanto, átomos são os componentes básicos das moléculas e da matéria comum.
Fonte: http://www.achetudoeregiao.com.br/animais/atomo.htm
Postado por: Rosimaira
Notícia
Pela primeira vez, cientistas do Centro Europeu de Pesquisas Nucleares, o Cern, conseguiram não só produzir como estocar e liberar, de forma controlada, átomos de anti-hidrogênio, a versão em antimatéria (ou seja, com a carga elétrica oposta) dos átomos de hidrogênio, os mais simples encontrados na natureza. Publicado antecipadamente no site da revista Nature, o artigo da equipe do dinamarquês Jeffrey Hangst descreve a tecnologia usada para criar e aprisionar por 170 milissegundos pelo menos 38 átomos desse "hidrogênio negativo". O estudo deve ajudar a explicar a predominância de matéria no universo.
publicado em 18 de novenbro de 2010
Fonte de Pesquisa: http://www.estadao.com.br
Postado por: Giovane
publicado em 18 de novenbro de 2010
Fonte de Pesquisa: http://www.estadao.com.br
Postado por: Giovane
Curiosidade!!!
Hoje, sabemos que o tamanho do átomo é de 10.000 a 100.000 vezes maior que o seu núcleo. Para efeito de comparação, podemos imaginar o núcleo atómico como uma formiga no centro de um estádio como o Maracanã (dos maiores estádios do mundo, situado no Brasil).
FÍSICA NUCLEAR
O estudo do núcleo (centro) do átomo é chamado Física Nuclear. Como resultado desse estudo os cientistas descobriram maneiras de dividir o núcleo do átomo para liberar grandes quantidades de energia.
Ao se partir um núcleo, ele faz com que muitos outros se dividam, numa reação nuclear em cadeia. Nas usinas nucleares as reações são controladas e produzem luz e calor para nossos lares. Usinas nucleares produzem artificialmente grandes quantidades de energia.
O Sol é a maior fonte de energia nuclear. A cada segundo no interior do Sol, ocorrem milhões de reações nucleares em cadeia, pois, o intenso calor do Sol fazem com que seus átomos se choquem uns contra os outros e simulam em reações conhecidas como fusão nuclear. O núcleo de cada átomo libera energia que sentimos na forma de calor e enxergamos na forma luz. Enormes explosões de energias, chamadas de protuberâncias solares, ocorrem ocasionalmente na superfície do Sol.
Postado por:Tanaiz
Fonte:http://www.algosobre.com.br/fisica/atomo.html
Ao se partir um núcleo, ele faz com que muitos outros se dividam, numa reação nuclear em cadeia. Nas usinas nucleares as reações são controladas e produzem luz e calor para nossos lares. Usinas nucleares produzem artificialmente grandes quantidades de energia.
O Sol é a maior fonte de energia nuclear. A cada segundo no interior do Sol, ocorrem milhões de reações nucleares em cadeia, pois, o intenso calor do Sol fazem com que seus átomos se choquem uns contra os outros e simulam em reações conhecidas como fusão nuclear. O núcleo de cada átomo libera energia que sentimos na forma de calor e enxergamos na forma luz. Enormes explosões de energias, chamadas de protuberâncias solares, ocorrem ocasionalmente na superfície do Sol.
Postado por:Tanaiz
Fonte:http://www.algosobre.com.br/fisica/atomo.html
terça-feira, 24 de maio de 2011
A estrutura do átomo: a ciência do início do século XX
Para conhecer a estrutura do átomo, precisamos saber o seguinte:
•quais são as partes do átomo;
•como é a organização dessas partes;
Ao final do século XIX, pensava-se que o átomo não era nada mais do que uma minúscula esfera indivisível (de acordo com a visão de Dalton). Contudo, uma série de novas descobertas nos campos da química, eletricidade e magnetismo, radioatividade e mecânica quântica, no final do século XIX e início do século XX, mudou tudo isso. Aqui estão as contribuições que esses campos trouxeram:
•as partes do átomo:
•química e eletromagnetismo ---> elétron (primeira partícula subatômica) •radioatividade ---> núcleo
•próton
•nêutron
•como é a organização do átomo - a mecânica quântica conseguiu juntar todas as peças:
•espectros atômicos ---> Modelo de Bohr sobre o átomo •dualidade partícula-onda ---> Modelo quântico do átomo
Fonte de pesquisa: http://ciencia.hsw.uol.com.br/atomos4.htm
Postado por: Thaís
•quais são as partes do átomo;
•como é a organização dessas partes;
Ao final do século XIX, pensava-se que o átomo não era nada mais do que uma minúscula esfera indivisível (de acordo com a visão de Dalton). Contudo, uma série de novas descobertas nos campos da química, eletricidade e magnetismo, radioatividade e mecânica quântica, no final do século XIX e início do século XX, mudou tudo isso. Aqui estão as contribuições que esses campos trouxeram:
•as partes do átomo:
•química e eletromagnetismo ---> elétron (primeira partícula subatômica) •radioatividade ---> núcleo
•próton
•nêutron
•como é a organização do átomo - a mecânica quântica conseguiu juntar todas as peças:
•espectros atômicos ---> Modelo de Bohr sobre o átomo •dualidade partícula-onda ---> Modelo quântico do átomo
Fonte de pesquisa: http://ciencia.hsw.uol.com.br/atomos4.htm
Postado por: Thaís
O conceito de átomo
Da Grécia antiga até hoje, sempre imaginamos do que é composta a matéria. Para compreender o problema, aqui vai uma simples demonstração extraída da obra "The Extraordinary Chemistry of Ordinary Things, 3rd Edition" (A química incomum das coisas comuns, 3ª edição), de Carl H. Snyder:
pegue um monte de clipes de papel (todos do mesmo tamanho e cor;
divida o monte em dois montes iguais;
divida cada um dos montes menores em dois montes iguais;
repita o passo anterior até você chegar a um monte com apenas um clipe. Esse clipe ainda funciona como um clipe de papel (ou seja, prende papéis soltos);
agora, pegue uma tesoura e corte esse clipe de papel pela metade. A metade do clipe de papel pode fazer o mesmo trabalho que um único clipe de papel inteiro faria?
Se você fizesse o mesmo com qualquer elemento químico, chegaria a uma parte indivisível que tem as mesmas propriedades do elemento, assim como o clipe de papel. Essa parte indivisível é o que chamamos de átomo.
Fonte de pesquisa: http://ciencia.hsw.uol.com.br/atomos1.htm
Postado por: Thaís
pegue um monte de clipes de papel (todos do mesmo tamanho e cor;
divida o monte em dois montes iguais;
divida cada um dos montes menores em dois montes iguais;
repita o passo anterior até você chegar a um monte com apenas um clipe. Esse clipe ainda funciona como um clipe de papel (ou seja, prende papéis soltos);
agora, pegue uma tesoura e corte esse clipe de papel pela metade. A metade do clipe de papel pode fazer o mesmo trabalho que um único clipe de papel inteiro faria?
Se você fizesse o mesmo com qualquer elemento químico, chegaria a uma parte indivisível que tem as mesmas propriedades do elemento, assim como o clipe de papel. Essa parte indivisível é o que chamamos de átomo.
Fonte de pesquisa: http://ciencia.hsw.uol.com.br/atomos1.htm
Postado por: Thaís
Musica do Átomo
Não deixem de olhar essa musica, achei interessante para o nosso assunto!!!
Postado por Isadora
RELÓGIO ATÔMICO
A medição do tempo para fins científicos deve ser muito precisa e o Relógio Atômico é o mais preciso de todos que existem atualmente. Ele mede as diminutas trocas de energia do interior dos átomos do metal Césio. Por serem muito regulares, as trocas criam um padrão preciso para medir o tempo. O Relógio Atômico mede as vibrações naturais dos átomos de Césio. Eles vibram mais de 9 bilhões de vezes por segundo, com isso, o Relógio Atômico atrasará poucos segundos a cada 100.000 anos.
Postado por:Tanaiz
Fonte:http://www.algosobre.com.br/fisica/atomo.html
Postado por:Tanaiz
Fonte:http://www.algosobre.com.br/fisica/atomo.html
FISSÃO NUCLEAR
Há dois tipos de reação nuclear: a fissão e a fusão. As usinas nucleares usam a fissão para produzir sua energia. Partículas atômicas que se movem com grande rapidez, chamadas nêutrons, são atiradas contra o núcleo do átomo para dividi-lo. Essa divisão é chamada fissão e faz com que os outros átomos também se dividam, numa reação em cadeia. Nesse processo, um pouco da massa (o número de partículas pesadas dentro do átomo) se perde, convertendo-se em imensas quantidades de energia.
Ao se iniciar uma reação de fissão nuclear, uma partícula rápida chamada nêutron é disparada contra o núcleo de um átomo de Urânio 235. O nêutron de alta velocidade, tem potência suficiente para penetrar no interior do núcleo onde é absorvido, em seguida, o núcleo se divide em duas partes num processo chamado fissão. Essa fissão produz mais dois ou três nêutrons que vão dividir mais núcleos numa reação em cadeia. Cada vez que um átomo sofre uma fissão, libera grande quantidade de energia.
Postado por:Tanaiz
Fonte:http://www.algosobre.com.br/fisica/atomo.html
Ao se iniciar uma reação de fissão nuclear, uma partícula rápida chamada nêutron é disparada contra o núcleo de um átomo de Urânio 235. O nêutron de alta velocidade, tem potência suficiente para penetrar no interior do núcleo onde é absorvido, em seguida, o núcleo se divide em duas partes num processo chamado fissão. Essa fissão produz mais dois ou três nêutrons que vão dividir mais núcleos numa reação em cadeia. Cada vez que um átomo sofre uma fissão, libera grande quantidade de energia.
Postado por:Tanaiz
Fonte:http://www.algosobre.com.br/fisica/atomo.html
ÁTOMOS NEUTROS
São átomos com a mesma carga de elétrons e prótons.
Quando um átomo possui a mesma quantidade de dois fica NEUTRO.
Postado por:Tanaiz
Fonte:www.física.net
Quando um átomo possui a mesma quantidade de dois fica NEUTRO.
Postado por:Tanaiz
Fonte:www.física.net
Prêmio Nobel de Química-1999
No dia 12 de outubro de 1999,a Real Academia Sueca de Ciências anunciou a concessão do Prêmio Nobel de Química ao pesquisador da dupla nacionalidade (egípcia e norte-americana),Ahmed H. Zewail ,''por ter demonstrado que é possível observar,graças a uma técnica a laser ultra-rápida,o movimento dos átomos de uma molécula durante as reações químicas''.
Zewail é o inventor de uma técnica que pode ser descrita como uma câmera fotográfica capaz de captar com precisão a forma como se comportam os átomos durante o exato momento de uma reação química.
Ahmed H. Zewail nasceu em 1946,no Egito.Fez seus primeiros estudos de Química na Universidade de Alexandria.Depois foi para os Estados Unidos, onde se doutorou em 1974,na Universidade da Pensilvânia.Trabalhou na Universidade de Berkeley e,em 1976,tornou-se pesquisador do Instituto de Tecnologia da Califórnia.
Postado por:Tanaiz
Fonte:http://netopedia.tripod.com/quimic/estrut_atomo.htm
Zewail é o inventor de uma técnica que pode ser descrita como uma câmera fotográfica capaz de captar com precisão a forma como se comportam os átomos durante o exato momento de uma reação química.
Ahmed H. Zewail nasceu em 1946,no Egito.Fez seus primeiros estudos de Química na Universidade de Alexandria.Depois foi para os Estados Unidos, onde se doutorou em 1974,na Universidade da Pensilvânia.Trabalhou na Universidade de Berkeley e,em 1976,tornou-se pesquisador do Instituto de Tecnologia da Califórnia.
Postado por:Tanaiz
Fonte:http://netopedia.tripod.com/quimic/estrut_atomo.htm
Estrutura
Os cientistas, por meio de técnicas avançadas, já perceberam a complexidade do átomo. Já comprovaram a presença de inúmeras partículas em sua constituição e desvendaram o comportamento dessas partículas. Mas para construir alguns conceitos que ajudam a entender a química do dia-a-dia, o modelo de átomo descrito por Rutherford-Bohr é suficiente. Na constituição dos átomos predominam os espaços vazios. O núcleo, extremamente pequeno, é constituído por prótons e nêutrons. Em torno dele, constituindo a eletrosfera, giram os elétrons.
O diâmetro da eletrosfera de um átomo é de 10,000 a 100,000 vezes maior que o diâmetro de seu núcleo, e sua estrutura interna pode ser considerada , para efeitos práticos, oca; pois para encher todo este espaço vazio de prótons e nêutrons (ou núcleos) necessitaríamos de um bilhão de milhões de núcleos…
O átomo de hidrogênio é constituído por um só próton com um só elétron girando ao seu redor. O hidrogênio é o único elemento cujo átomo pode não possuir nêutrons.
O elétron e o próton possuem a mesma carga, porém não a mesma massa. O próton é 1836,11 vezes mais massivo que o elétron. Usando, como exemplo hipotético, um átomo de vinte prótons e vinte nêutrons em seu núcleo, e este estando em equilíbrio eletrodinâmico, terá vinte elétrons orbitando em suas camadas exteriores. Sua carga elétrica estará em perfeito equilíbrio eletrodinâmico, porém 99,97% de sua massa encontrar-se-á no núcleo. Apesar do núcleo conter praticamente toda a massa, seu volume em relação ao tamanho do átomo e de seus orbitais é minúsculo. O núcleo atômico mede em torno de 10 - 13 (1 fm) centímetros de diâmetro, enquanto que o átomo mede cerca de 10 − 8 centímetros (100 pms).
Fonte: http://pt.wikipedia.org/wiki
Postado por: Jenifer
O diâmetro da eletrosfera de um átomo é de 10,000 a 100,000 vezes maior que o diâmetro de seu núcleo, e sua estrutura interna pode ser considerada , para efeitos práticos, oca; pois para encher todo este espaço vazio de prótons e nêutrons (ou núcleos) necessitaríamos de um bilhão de milhões de núcleos…
O átomo de hidrogênio é constituído por um só próton com um só elétron girando ao seu redor. O hidrogênio é o único elemento cujo átomo pode não possuir nêutrons.
O elétron e o próton possuem a mesma carga, porém não a mesma massa. O próton é 1836,11 vezes mais massivo que o elétron. Usando, como exemplo hipotético, um átomo de vinte prótons e vinte nêutrons em seu núcleo, e este estando em equilíbrio eletrodinâmico, terá vinte elétrons orbitando em suas camadas exteriores. Sua carga elétrica estará em perfeito equilíbrio eletrodinâmico, porém 99,97% de sua massa encontrar-se-á no núcleo. Apesar do núcleo conter praticamente toda a massa, seu volume em relação ao tamanho do átomo e de seus orbitais é minúsculo. O núcleo atômico mede em torno de 10 - 13 (1 fm) centímetros de diâmetro, enquanto que o átomo mede cerca de 10 − 8 centímetros (100 pms).
Fonte: http://pt.wikipedia.org/wiki
Postado por: Jenifer
Modelo de Dalton
John Dalton, em 1803, criou um modelo que retomava o antigo conceito dos gregos. Ele imaginou o átomo como uma pequena esfera, com massa definida e propriedades características. Dessa forma, todas as transformações químicas podiam ser explicadas pelo arranjo de átomos. Toda matéria é constituída por átomos. Esses são as menores partículas que a constituem; são indivisíveis e indestrutíveis, e não podem ser transformados em outros, nem mesmo durante os fenômenos químicos. Os átomos de um mesmo elemento químico são idênticos em massa e se comportam igualmente em transformações químicas. As transformações químicas ocorrem por separação e união de átomos. Isto é, os átomos de uma substância que estão combinados de um certo modo, separam-se, unindo-se novamente de uma outra maneira.
Fonte:http://pt.wikipedia.org/wiki
Postado por: Jenifer
Fonte:http://pt.wikipedia.org/wiki
Postado por: Jenifer
Interações atômicas
Dalton descobriu também que esses átomos de características próprias, conforme o tipo, reagem entre si de acordo com proporções numéricas simples, deixando claro que as diferentes combinações e transformações da matéria eram resultantes das interações entre seus átomos.
A partir do século 19, aconteceu um grande número de descobertas e teorias a respeito da natureza dos átomos:
Faraday, estudando a eletrólise, lançou a idéia de que a eletricidade estivesse associada aos átomos;
Röentgen descobriu os raios X;
Becquerel descobriu a radiatividade;
Marie e Pierre Curie descobriram os elementos rádio e polônio.
Em meio a este acúmulo de evidências, ficava cada vez mais claro aos cientistas que o átomo deveria ser algo mais que uma bolinha maciça muito pequena. A idéia dos gregos de que a menor partícula da matéria deveria seria uniforme e indivisível começava a cair por terra.
http://educacao.uol.com.br/quimica/ult1707u15.jhtm
Postado por Deborah
A partir do século 19, aconteceu um grande número de descobertas e teorias a respeito da natureza dos átomos:
Faraday, estudando a eletrólise, lançou a idéia de que a eletricidade estivesse associada aos átomos;
Röentgen descobriu os raios X;
Becquerel descobriu a radiatividade;
Marie e Pierre Curie descobriram os elementos rádio e polônio.
Em meio a este acúmulo de evidências, ficava cada vez mais claro aos cientistas que o átomo deveria ser algo mais que uma bolinha maciça muito pequena. A idéia dos gregos de que a menor partícula da matéria deveria seria uniforme e indivisível começava a cair por terra.
http://educacao.uol.com.br/quimica/ult1707u15.jhtm
Postado por Deborah
O modelo atômico de Thomson
O britânico Joseph John Thomson descobriu os elétrons em 1897 por meio de experimentos envolvendo raios catódicos em tubos de crookes. O tubo de crookes consiste-se em uma ampola que contém apenas vácuo e um dispositivo elétrico que faz os elétrons de qualquer material condutor saltar e formar feixes, que são os próprios raios catódicos. Thomson, ao estudar os raios catódicos, descobriu que estes são afetados por campos elétrico e magnético, e deduziu que a deflexão dos raios catódicos por estes campos são desvios de trajetória de partículas muito pequenas de carga negativa, os elétrons.
Thomson propos que o átomo era, portanto, divisível, em partículas carregadas positiva e negativamente, contrariando o modelo indivisível de átomo proposto por Dalton (e por atomistas na Antiga Grécia). O átomo consistiria de vários elétrons incrustados e embebidos em uma grande partícula positiva, como passas em um pudim. O modelo atômico do "pudim com passas" permaneceu em voga até a descoberta do núcleo atômico por Ernest Rutherford.
Thomson propos que o átomo era, portanto, divisível, em partículas carregadas positiva e negativamente, contrariando o modelo indivisível de átomo proposto por Dalton (e por atomistas na Antiga Grécia). O átomo consistiria de vários elétrons incrustados e embebidos em uma grande partícula positiva, como passas em um pudim. O modelo atômico do "pudim com passas" permaneceu em voga até a descoberta do núcleo atômico por Ernest Rutherford.
Postado por: Jenifer
Força de Van der Waals
A carga eletrônica não se distribui de maneira uniforme, algumas partes da superfície atômica são menos negativas que outras. Em função disto, a carga positiva que se encontra no interior do átomo infiltrar-se-á pelas áreas menos negativas externas, por isso haverá uma débil atração eletrostática entre os dois átomos chamada de força de Van der Waals.
Em baixíssima temperatura, os átomos de hélio movem-se muito lentamente, seu ricochete diminui a tal grau que é insuficiente para vencer as forças de Van der Waals, como o átomo de hélio é altamente simétrico, por este motivo as forças atuantes neste elemento são muito fracas. A contração do hélio ocorre e este acaba por se liquefazer a 4,3 graus acima do zero absoluto.
Nos demais gases presentes na natureza sua distribuição de cargas é menos simétrica que no hélio, as forças de Van der Waals são maiores ocasionando uma liquefação em temperaturas maiores.
Fonte:http://pt.wikipedia.org/wiki/
Postado por: Jenifer
Em baixíssima temperatura, os átomos de hélio movem-se muito lentamente, seu ricochete diminui a tal grau que é insuficiente para vencer as forças de Van der Waals, como o átomo de hélio é altamente simétrico, por este motivo as forças atuantes neste elemento são muito fracas. A contração do hélio ocorre e este acaba por se liquefazer a 4,3 graus acima do zero absoluto.
Nos demais gases presentes na natureza sua distribuição de cargas é menos simétrica que no hélio, as forças de Van der Waals são maiores ocasionando uma liquefação em temperaturas maiores.
Fonte:http://pt.wikipedia.org/wiki/
Postado por: Jenifer
O modelo atômico de Niels Bohr e a mecânica quântica
O modelo planetário de Niels Bohr foi um grande avanço para a comunidade científica, provando que o átomo não era maciço. Segundo a Teoria Eletromagnética, toda carga elétrica em movimento em torno de outra, perde energia em forma de ondas eletromagnéticas. E justamente por isso tal modelo gerou certo desconforto, pois os elétrons perderiam energia em forma de ondas eletromagnéticas, confinando-se no núcleo, tornando a matéria algo instável.
Bohr, que trabalhava com Rutherford, propôs o seguinte modelo: o elétron orbitaria o núcleo em órbitas estacionárias, sem perder energia. Entre duas órbitas, temos as zonas proibidas de energia, pois só é permitido que o elétron esteja em uma delas. Ao receber um quantum, o elétron salta de órbita, não num movimento contínuo, passando pela área entre as órbitas (daí o nome zona proibida), mas simplesmente desaparecendo de uma órbita e reaparecendo com a quantidade exata de energia. Se um pacote com energia insuficiente para mandar o elétron para órbitas superiores encontrá-lo, nada ocorre. Mas se um fóton com a energia exata para que ele salte para órbitas superiores, certamente o fará, depois, devolvendo a energia absorvida em forma de ondas eletromagnéticas.
Fonte:http://pt.wikipedia.org/wiki/NielsBohr
Postado por: Jenifer
Bohr, que trabalhava com Rutherford, propôs o seguinte modelo: o elétron orbitaria o núcleo em órbitas estacionárias, sem perder energia. Entre duas órbitas, temos as zonas proibidas de energia, pois só é permitido que o elétron esteja em uma delas. Ao receber um quantum, o elétron salta de órbita, não num movimento contínuo, passando pela área entre as órbitas (daí o nome zona proibida), mas simplesmente desaparecendo de uma órbita e reaparecendo com a quantidade exata de energia. Se um pacote com energia insuficiente para mandar o elétron para órbitas superiores encontrá-lo, nada ocorre. Mas se um fóton com a energia exata para que ele salte para órbitas superiores, certamente o fará, depois, devolvendo a energia absorvida em forma de ondas eletromagnéticas.
Fonte:http://pt.wikipedia.org/wiki/NielsBohr
Postado por: Jenifer
Modelo Atômico de Rutherford
Em 1911, realizando experiências de bombardeio de lâminas de ouro com partículas alfa (partículas de carga positiva, liberadas por elementos radioativos), Rutherford fez uma importante constatação: a grande maioria das partículas atravessava diretamente a lâmina, algumas sofriam pequenos desvios e outras, em número muito pequeno (uma em cem mil), sofriam grandes desvios em sentido contrário.
A partir dessas observações, Rutherford chegou às seguintes conclusões:
Rutherford demonstrou, ainda, que praticamente toda a massa do átomo fica concentrada na pequena região do núcleo.
Dois anos depois de Rutherford ter criado o seu modelo, o cientista dinamarquês Niels Bohr o completou, criando o que hoje é chamado modelo planetário. Para Bohr, os elétrons giravam em órbitas circulares, ao redor do núcleo. Depois desses, novos estudos foram feitos e novos modelos atômicos foram criados. O modelo que representa o átomo como tendo uma parte central chamado núcleo, contendo prótons e nêutrons, serve para explicar um grande número de observações sobre os materiais.
Fonte:http://pt.wikipedia.org/wiki/Rutherford
Postado por: Jenifer
A partir dessas observações, Rutherford chegou às seguintes conclusões:
- No átomo existem espaços vazios; a maioria das partículas o atravessava sem sofrer nenhum desvio.
- No centro do átomo existe um núcleo muito pequeno e denso; algumas partículas alfa colidiam com esse núcleo e voltavam, sem atravessar a lâmina.
- O núcleo tem carga elétrica positiva; as partículas alfa que passavam perto dele eram repelidas e, por isso, sofriam desvio em sua trajetória.
Rutherford demonstrou, ainda, que praticamente toda a massa do átomo fica concentrada na pequena região do núcleo.
Dois anos depois de Rutherford ter criado o seu modelo, o cientista dinamarquês Niels Bohr o completou, criando o que hoje é chamado modelo planetário. Para Bohr, os elétrons giravam em órbitas circulares, ao redor do núcleo. Depois desses, novos estudos foram feitos e novos modelos atômicos foram criados. O modelo que representa o átomo como tendo uma parte central chamado núcleo, contendo prótons e nêutrons, serve para explicar um grande número de observações sobre os materiais.
Fonte:http://pt.wikipedia.org/wiki/Rutherford
Postado por: Jenifer
ISÓTOPOS,ISÓBAROS,ISÓTONOS E ISOELETRÔNICOS
Isótopos:são átomos de um mesmo elemento químico que apresentam diferentes números de massa e diferentes números de nêutrons.
Isóbaros:são átomos de elementos químicos diferentes mas com mesmo número de massa.
Isótonos:são átomos de elementos químicos diferentes mas com mesmo número de nêutrons.
Isoeletrônicos:são átomos que apresentam o mesmo número de elétrons.
Postado por:Tanaiz
Fonte:http://www.mundofisico.joinville.udesc.br
Isóbaros:são átomos de elementos químicos diferentes mas com mesmo número de massa.
Isótonos:são átomos de elementos químicos diferentes mas com mesmo número de nêutrons.
Isoeletrônicos:são átomos que apresentam o mesmo número de elétrons.
Postado por:Tanaiz
Fonte:http://www.mundofisico.joinville.udesc.br
sábado, 21 de maio de 2011
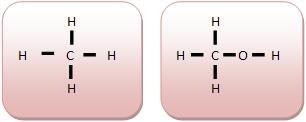
Classificação dos Átomos de Carbono
• Carbono Primário: Um átomo que liga-se a um outro átomo de carbono. Os átomos de carbonos situados nas extremidades da cadeia tornam-se primário.
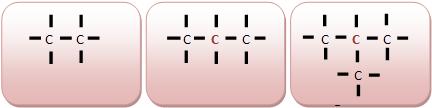
Modo primário acontece quando na molécula existe apenas um átomo de carbono.
• Carbono Secundário: Um átomo que liga-se a dois outros átomos de carbono.
• Carbono Terciário: Um átomo que liga-se a três outros átomos de carbono.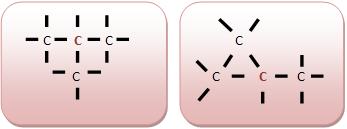
• Carbono Quaternário: Um átomo que liga-se a quatro outros átomos de carbono.
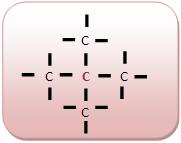
Fonte de Pesquisa: http://www.colegioweb.com.br/quimica/classificacao-dos-atomos-de-carbono.html
Postado por: Rafael P. Silva

Modo primário acontece quando na molécula existe apenas um átomo de carbono.

• Carbono Secundário: Um átomo que liga-se a dois outros átomos de carbono.

• Carbono Terciário: Um átomo que liga-se a três outros átomos de carbono.

• Carbono Quaternário: Um átomo que liga-se a quatro outros átomos de carbono.

Fonte de Pesquisa: http://www.colegioweb.com.br/quimica/classificacao-dos-atomos-de-carbono.html
Postado por: Rafael P. Silva
sexta-feira, 20 de maio de 2011
Radioatividade
A radioatividade está ligada diretamente ao núcleo do átomo. Em uma reação nuclear, o átomo emite radiação (raios alfa, beta e gama), o que provoca alterações no núcleo, em geral, fazendo com que se transforme em outros elementos. Às vezes, porém, pode apenas ocorrer uma mudança da massa total do átomo, sem que se altere o número atômico.
Quando o número de prótons muda em um átomo, as características do material são alteradas porque o núcleo atômico passa a ter massa e carga diferentes. Dessa forma, ele deixa de ser o mesmo átomo de antes, transformando-se em um outro elemento químico.
O número de nêutrons pode variar em um átomo sem mudar as características elétricas, pois os nêutrons interferem apenas na massa. Os átomos que possuem mesma quantidade de prótons e quantidades diferentes de nêutrons são conhecidos como isótopos.
Postado por: Thaís
O Comportamento Atômico
Mas o que define o comportamento dos átomos? Os prótons e nêutrons estão nas regiões mais internas dos átomos: os núcleos. Os elétrons estão nas mais externas, a eletrosfera.
As partículas subatômicas que possuem carga elétrica de mesma intensidade, mas opostas, são os prótons e os elétrons. O balanço entre as partículas subatômicas que possuem cargas elétricas dará a característica elétrica do material. A massa é dada pela quantidade de prótons e nêutrons, já que os elétrons têm massa desprezível.
O número de elétrons de um átomo pode variar, mudando a carga total do átomo. Segundo o modelo atômico de Bohr, os elétrons podem ganhar energia e passar a camadas eletrônicas mais distantes do núcleo.
Nas reações químicas, as mudanças ocorrem com a eletrosfera. Seja por atração de outros núcleos atômicos ou por terem recebido energia suficiente, os elétrons podem deixar seu átomo de origem. Esse não perde massa, pois, como já foi visto anteriormente, a massa do elétron é desprezível.
Em um átomo, normalmente, o número de prótons e nêutrons é invariável. Sendo assim, o próton é a única partícula que possui carga e não deixa facilmente o átomo. Portanto é o número de prótons que caracteriza um elemento químico, ou seja, é o número de prótons que indica qual átomo fará parte de um determinado grupo.
Postado por: Thaís
segunda-feira, 16 de maio de 2011
sexta-feira, 13 de maio de 2011
O átomo é um elemento tão pequeno, que nem com um microscópio eletrônico conseguiria enxergar . Em livros, aparece vários modelos semelhantes ao de John Dalton que foi o primeiro cientista a propor um modelo para os átomos. os átomos são índivisiveis e são como uma bola maciça, quando os átomos se unem formam substâncias.
Postado por Isadora
Postado por Isadora
quinta-feira, 5 de maio de 2011
Número atômico (Z)
Um elemento químico é um conjunto de átomos que tem o mesmo número de prótons no núcleo. Este número é conhecido como o número atômico do elemento. Por exemplo, todos átomos com seis prótons no núcleo são átomos do elemento carbono.
De forma inversa, denomina-se elemento químico todos os átomos que possuem o mesmo número atômico (Z), ou seja, o mesmo número de prótons.
* Oxigênio é o elemento químico constituído por todos os átomos que possuem número atômico 8, ou seja, com 8 prótons.
* Cálcio é o elemento químico constituído por todos os átomos que possuem número atômico 20, ou seja, com 20 prótons.
Portanto, o número atômico é característica para cada elemento químico, sendo o seu número de identificação.
Para representar o número atômico de um elemento juntamente com seu símbolo, usamos a notação ZE (com o número de massa em subscrito à esquerda do símbolo), onde Z é o número atômico e E é o símbolo do elemento. Por exemplo, 80 (oxigênio, com 8 prótons), 20Ca.
Fonte de pesquisa: http://pt.wikibooks.org/wiki/Introdu%C3%A7%C3%A3o_%C3%A0_Qu%C3%ADmica/Caracter%C3%ADsticas_dos_%C3%A1tomos
Postado por: Thaís
De forma inversa, denomina-se elemento químico todos os átomos que possuem o mesmo número atômico (Z), ou seja, o mesmo número de prótons.
* Oxigênio é o elemento químico constituído por todos os átomos que possuem número atômico 8, ou seja, com 8 prótons.
* Cálcio é o elemento químico constituído por todos os átomos que possuem número atômico 20, ou seja, com 20 prótons.
Portanto, o número atômico é característica para cada elemento químico, sendo o seu número de identificação.
Para representar o número atômico de um elemento juntamente com seu símbolo, usamos a notação ZE (com o número de massa em subscrito à esquerda do símbolo), onde Z é o número atômico e E é o símbolo do elemento. Por exemplo, 80 (oxigênio, com 8 prótons), 20Ca.
Fonte de pesquisa: http://pt.wikibooks.org/wiki/Introdu%C3%A7%C3%A3o_%C3%A0_Qu%C3%ADmica/Caracter%C3%ADsticas_dos_%C3%A1tomos
Postado por: Thaís
domingo, 1 de maio de 2011
Interação Atômica!
Se tivermos dois átomos hipotéticos, cuja carga elétrica seja neutra, presume-se que estes não se afetarão mutuamente por causa da neutralidade da força eletromagnética entre si.
A distribuição de cargas no átomo se dá de forma diversa. A carga negativa é externa, a carga positiva é interna, isto ocorre por que os elétrons orbitam o núcleo. Quando aproximamos dois átomos, mesmo estando em perfeita neutralidade interna, estes se repelem, se desviam ou ricocheteiam.
Exemplo típico ocorre no elemento hélio (He) onde seus átomos estão em eterno movimento de mútuo ricochete. Em temperatura ambiente, o gás hélio tem no movimento de seus átomos um rápido ricochete. Ao diminuir a temperatura, o movimento oscilatório diminui, o volume fica menor e a densidade aumenta. Chegaremos teoricamente num ponto em que o movimento de ricochete diminuirá tanto que não se poderá mais retirar energia deste. A este nível térmico, damos o nome de zero absoluto, este é –273,15 Cº
postado por: Rafael
fonte: http://www.brasilescola.com/quimica/interacao-atomica.html
Atração Atômica
Nas regiões externas dos átomos, a distribuição eletrônica se dá em camadas, sua estrutura apresenta a estabilidade máxima se estas estiverem completas. Com exceção do hélio e outros elementos com estabilidade e simetria semelhante, geralmente a camada mais exterior do átomo é incompleta, ou podem possuir excesso de elétrons. Em função disto pode haver a transferência de um ou dois elétrons do átomo em que estão em excesso, para o átomo em que estão em falta, deixando as camadas externas de ambos em equilíbrio.
O átomo que recebe elétrons ganha carga negativa, e o que perdeu não equilibra totalmente sua carga nucléica, positiva. Ocorre então o aglutinamento atômico.
Existe ainda o caso de dois átomos colidirem. Ocorrendo, há o compartilhamento eletrônico entre ambos que passam a ter suas camadas mais externas completas desde que permaneçam em contato. pois eles tem em excesso um números de neutros.
Fonte de pesquisa: http://pt.wikipedia.org/
Google imagens
postado por : Adalberto
Assinar:
Postagens (Atom)





